日前,德国癌症研究中心、海德堡大学、海德堡重离子治疗中心和普朗克核物理研究所联合研究了一种在线测量人体元素组成的新技术,该技术基于质子重离子治疗过程中激发的伽马射线光谱(PIBS, proton and ion beam spectroscopy)。其实验结果发表在Nature子刊Scientific Reports。

该技术继承了在线射程验证的瞬发伽马成像技术和瞬发伽马中子活化分析。制备了水溶液样品来模拟不同的氧和碳浓度,用质子和离子束照射这些样品和其他组织替代物,清楚的显示了目标元素组成和瞬时伽马产生之间的对数关系。脂肪、大脑、乳房、肝脏、肌肉和骨骼相关组织中钙元素浓度变化为1%,氧元素浓度变化为2%,这种差别被清楚的验证。实时体内氧、碳和钙浓度的测量将在临床前和临床环境中进行评估。这项技术在评估肿瘤在几个治疗阶段的缺氧和追踪脑转移的钙化上有重要的作用。
技术背景
1964年,Anderson等人首先描述了通过辐照粒子对人体元素组成的分析。该技术被称为体内中子活化分析。能够识别出活化的元素是因为它们以不同的速率衰减,或因为它们发出了不同能量的伽马射线。后者得到进一步发展,并被提名为即时体内γ中子分析(PGIVNA或IVNAA)。IVNAA对人体总蛋白质的评估以及重症监护患者产生了重大影响,因此每年在全世界节省数十亿美元。
IVNAA依靠高纯锗探测器(HPGe)来跟踪钙、镉和氯,或者依靠厚碘化钠NaI(Tl)探测器来确定体内的氢和氮。这项技术是在核反应堆、粒子加速器或放射性同位素中子源附近开发的。为了研究中子活化元素光谱的快速活化,中子活化分析在材料科学主要用作一种有效的非破坏性的多元素探测技术。
2011年,MD安德森癌症中心的研究人员建议在质子治疗期间测量瞬发伽马射线发射以评估治疗的进行程度和患者的反应。250 MeV的质子束轰击氧含量从70%变为50%的低氧区域的模拟清楚的显示了氧浓度与质子诱导的瞬发伽马射线产生之间的对数趋势。2013年,该团队证明了在组织当量样品中的辐照氧克数与质子辐照期间用HPGe探测器探测到的6.13 MeV瞬发伽马的总发射之间存在线性关系。NIST中子研究中心PGAA设施中NIST研究小组的最新工作能够使用康普顿相机确定中子辐照过程中瞬发伽马发射引起的氢浓度。
Stichelbaut和Jongen首先提出了用于实时体内验证人体组织中质子和离子束射程的瞬发伽马成像技术。此后,几个原型机被开发,其中有两个系统已经达到临床阶段。虽然瞬发伽马能谱(PGS)作为一种能够测量患者绝对射程偏差的技术而出现,但由于PGS的光谱的特殊性质,因此还可以用来确定受照人体组织内的元素浓度,这种特征与粒子的射程范围有关,人体组织成分最终会影响射束停止的位置,从而影响空间分辨率。
结果
实验装置如图1所示,图1a:由治疗头,靶和CeBr3探测器组成的实验装置照片。图1b:类似的装置的照片,其中较大的靶目标被较高的能量照射。图1c:用垂直于氧束流放置的EBT膜的目标物正面的照片。图1d:同一靶标的侧视图,在靶标内并沿光束轴放置有EBT膜。

图1
图2显示密度越高,样品内束流的路径越短。射程=EBT照射膜(cm)+3.8 cm(第一个烧瓶)。图2a:质子束照射的薄膜。观察到大的半影和非常陡峭的剂量下降。图2b:被氦束照射的膜。横向散射不太明显,但观察到的剂量下降幅度较小。图2c:被碳束照射的膜。射程末端更加尖锐,但是在停止点之后观察到相当大的碎片。图2d:氧束照射的薄膜。射程末端非常尖锐,但是以在停止点之后有非常强烈的碎片。
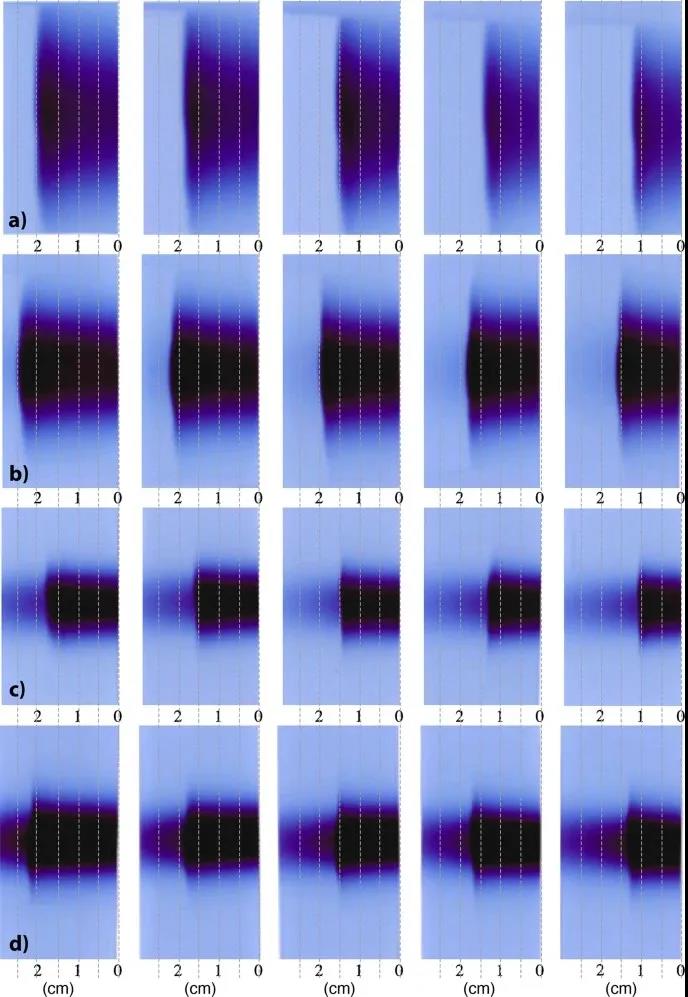
图2
下表是上述图中用于照射的束流能量和光斑尺寸以及靶的配比情况汇总。

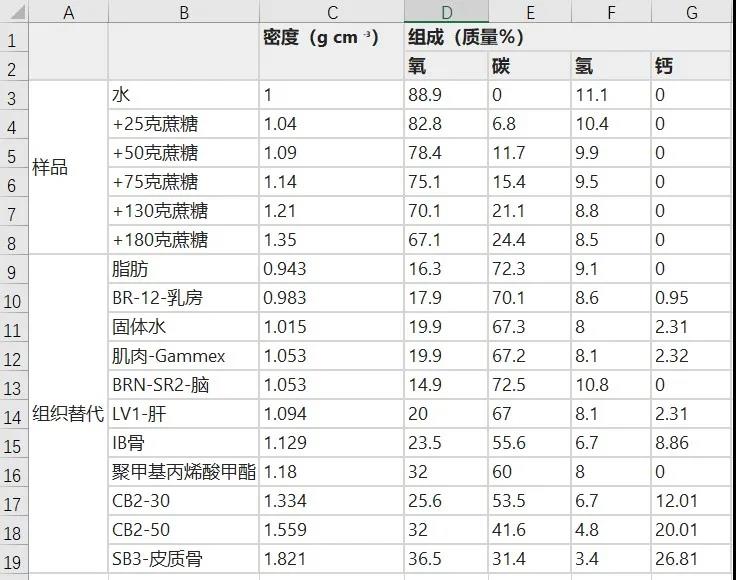
图3显示了质子、氦和碳束辐照水和石墨所产生的瞬发伽马能谱。观察到质子和氦离子在高于3 MeV时会产生较高的瞬发伽马产量,而碳离子在低于3 MeV时会产生较高的瞬发伽马产量,尤其是在0.718 MeV时。因此,质子和氦离子更适合于测量高能瞬发伽马,碳离子更适合于测量低能瞬发伽马。研究人员观察到,碳离子瞬发产生的γ产率分别比水和石墨靶的质子高6.6和21倍。
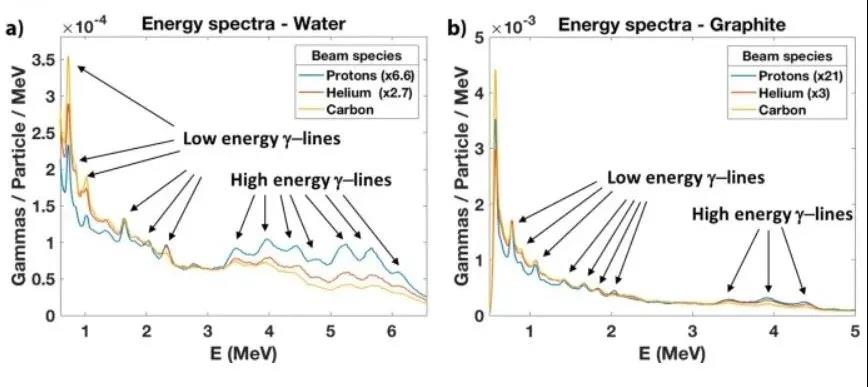
图3
图4给出了低能瞬发伽马(图4a)和高能瞬发伽马(图4b)的水和糖样品的辐照能谱。研究人员观察到,在0.718 MeV时,随着氧浓度的增加,瞬发伽马值降低。该能量线是由碳核的激发,退激发后以0.718 MeV的瞬时发射产生的。相反,5.2 MeV和6.1 MeV的能量峰随氧浓度的增加而增加。这些能量线是由氧核的激发产生,随后是具有相应能量的即时发射。对于高能瞬发伽马区域,用氦离子辐照的相同样品观察到相同的行为(图4c)。此外,本文观察到4.4 MeV谱线由于与氧和碳核的竞争反应而保持不变。但是,相应的单峰(3.9 MeV)和双逸峰(3.4 MeV)随着氧浓度的增加而降低。在确定每个样品的氧辐照质量后,研究人员绘制了氦辐照的克数与5.2 MeV能量峰内探测到的瞬发伽马值之间的线性趋势(图 4d)。辐照质量的平均统计不确定度为Δmo=46.7 mg,每次运行记录大约260万计数。
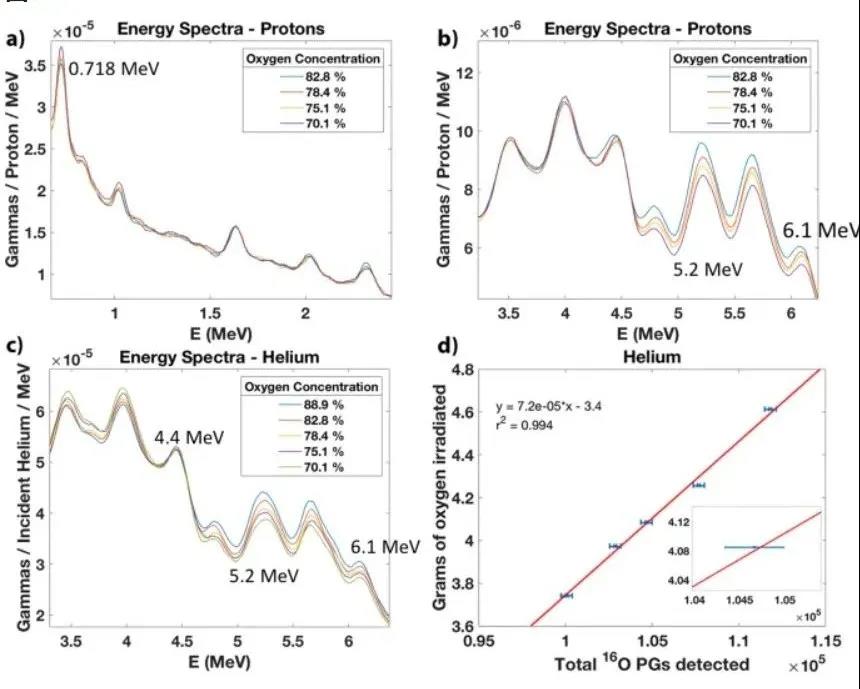
图4
图5a显示了另一个设置,其中,本文的靶是由两个水烧瓶组成的,而第三个烧瓶则包含准备好的五个样本之一。图5b显示了质子辐照三个烧瓶的能谱。两次辐照之间仅更换最后一个烧瓶。同样在这里,本文观察到氧浓度增加与5.2 MeV和6.1 MeV能量产生瞬发伽马光子存在明显趋势。对于高氧浓度获得的几个数据点符合氧浓度和瞬发伽马产生之间的对数趋势(图5c)。平均统计不确定度为2.85×10-8。氧浓度的不确定性范围从Δ[O]=0.95% ([O]=70.1%)到Δ[O]=0.24% ([O]=88.9%)。每次运行本文记录了7.5到800万个计数。
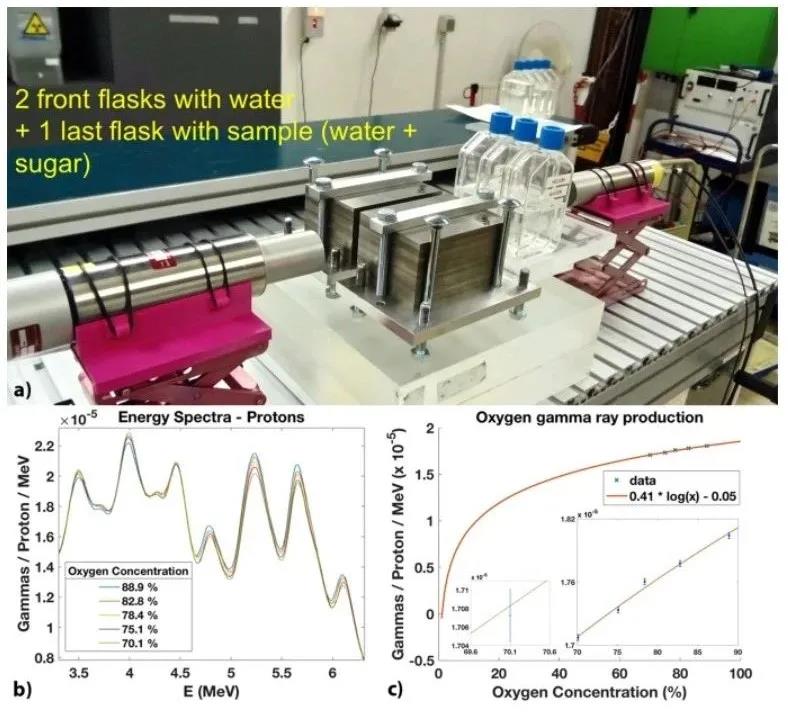
图5
为得到更多比例的氧浓度,实验添加了多种人体组织替代物,如下表:
照射水溶液和组织替代插入物后,本文获得了每个目标的瞬发伽马能谱。图6a、6b分别显示了氦和碳束辐照后获得的高能区域的17个瞬发伽马光谱。本文还显示了2个独立探测器的结果,这些探测器彼此相对且距目标的距离相似。本文观察到目标的氧浓度越高,在5.2 MeV的能量峰内瞬发产生的伽马越多。这些结果弥合了来自组织替代插入物的低氧浓度与来自水加糖样品的高氧浓度之间的差距。图6c中显示的结果明显符合MD安德森癌症中心模拟的对数趋势。
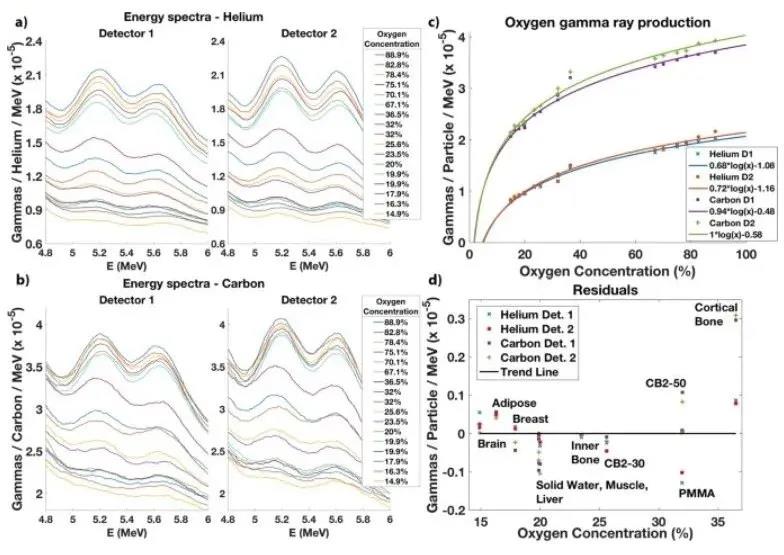
图6
瞬发伽马光子产额由k1×log(x)-k2给出,其中x是氧浓度,k1和k2是取决于几何形状(例如,从探测器器到目标的距离)和射束种类的常数。图6a、6b显示了由氦和碳束辐照6种水溶液和11种组织替代插入物引起的瞬发伽马能谱。图6c显示来自水和糖的氧浓度较高的样品的辐照数据和来自组织氧离子浓度较低的组织替代插入物的辐照数据显然符合对数趋势。图6d显示每个组织替代的数据点和趋势之间的残差对于光束种类和两个探测器都显示出很小的偏差。脑、脂肪、CB2-50和皮质骨替代物的结果高于趋势,而固体水、肌肉、肝脏、内骨骼和CB2-30替代物的结果低于趋势。PMMA的结果低于氦束的趋势,而CB2-50替代的结果高于碳束的趋势。氦离子平均统计不确定性是5.34×10-8,碳离子是7.88×10-8。氦束的氧浓度不确定性范围为Δ[O]0=0.20%([O]=14.9%)到Δ[O]=1.83% ([O]=88.9%),碳束的氧浓度不确定性范围为Δ[O]=0.22%([O]=14.9%)到Δ[O]=1.55% ([O]=88.9%)。
最后,本文也评估了元素浓度与探测到的总瞬发伽马之间的关系是否也适用于其他元素,例如钙。在这里,本文用EBT膜包裹后仅用氦束辐照组织替代插入物。图7a显示了高能量区域的12个瞬发伽马光谱。本文再次观察到,组织中的氧浓度越高,在5.2 MeV的能量峰内瞬发产生的伽马越多。相反,组织中的碳浓度越高,在4.4 MeV单逸和双逸能量峰内瞬发产生的γ越高。图7b证实并再现了氦辐照的氧克数与水溶液和组织替代插入物在5.2 MeV峰内产生的总瞬发伽马之间的线性关系:mo[g]=7.3×10−5×Nγ52MeV−3。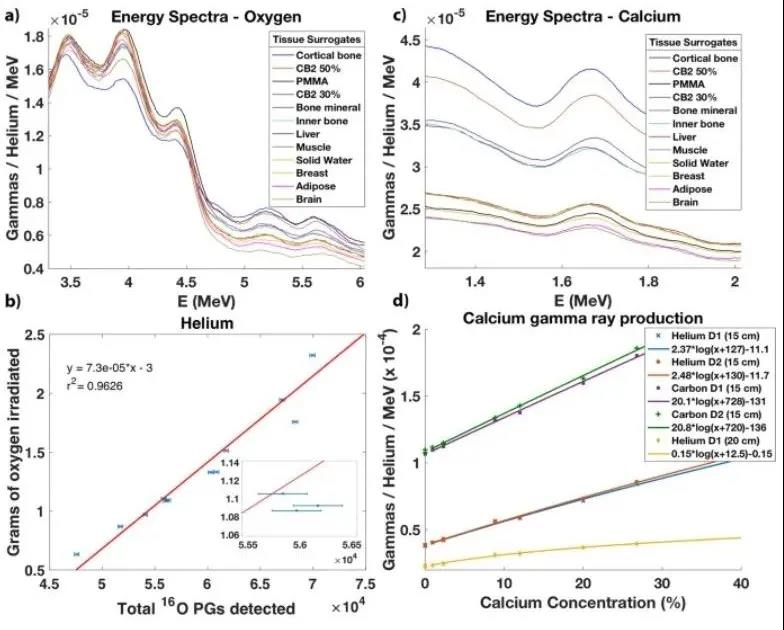
图7
图7d显示了钙浓度与瞬发产生γ之间的明确关系。乳房替代品中的钙含量为0.95%,而脂肪和大脑替代品中的钙含量不高。固体水、肌肉和肝脏替代物的浓度为2.3%。显然,这些变化与瞬发产生的伽马是有区别的。氦离子的平均统计不确定度为1.72×10-7,碳离子的平均统计不确定度为2.74×10-7。氦束的钙浓度的不确定性范围为Δ[Ca]=0.14% ([Ca]=0.95%) 到 Δ[Ca]=0.28%([Ca]=26.8%)。碳束是Δ[Ca]=0.15%([Ca]=2.31%) 到 Δ[Ca]=0.25% ([Ca]=26.8%)。
讨论
瞬发伽马光谱是时下质子和离子的射程范围验证最有前途的技术,该技术的光谱性质还可以确定人体的元素组成。研究人员提出了一种临床场景,质子、氦和碳离子不仅会照射具有高氧浓度的水加糖溶液的样品,还会照射具有较低氧浓度和可变钙浓度的组织替代插入物。相比以前的研究工作,本文使用CeBr3探测器代替HPGe探测器。该技术将进一步提升粒子精准治疗的应用前景。