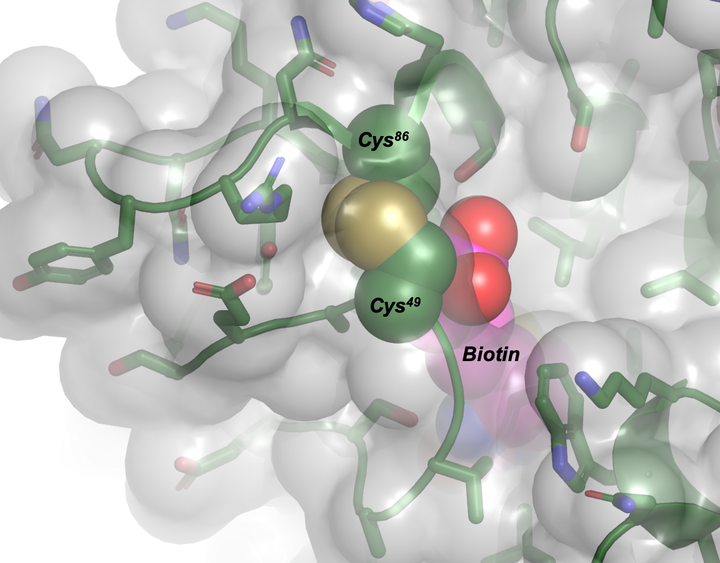
在CLS的CMCF光束线上确定的M88突变蛋白的晶体结构,揭示了Cys49和Cys86(绿色球体)之间形成的工程二硫化物如何部分阻断生物素(品红色球体)的出口途径。
必不可少的维生素和纯化的细菌蛋白之间的独特关系已在科学和医学领域用作有价值的工具几十年了。这两个分子,称为链霉亲和素和生物素,形成非常强而特异性的相互作用,这对于许多生物技术应用而言都是无价的。
用生物素标记分子并用抗生蛋白链菌素检测分子是许多实验室测试的常见部分,并已在医学上实现了许多科学发现。链霉亲和素和生物素对于木工来说对于实验室技术人员而言至关重要。这两种分子结合形成“分子胶”,用于许多用于诊断诸如HIV,丙型肝炎和莱姆病等传染病,发现新蛋白,病毒和细菌以及探索分子在活生物体中的功能的测试。
链霉亲和素与生物素的极其紧密和特异的结合使其成为生物技术和生物医学科学中的宝贵工具,但是缺乏有效的干扰相互作用的方法也极大地限制了其使用。
卡尔加里大学(加拿大卡尔加里)的Sui-lam Wong博士和温莎大学(加拿大安大略省温莎)的教授,兼任卡尔加里大学的兼职教授Kenneth Ng博士数十年来,我们一直在试图微调两个分子之间的键合,从而为精细的生物医学应用创造出更加有效的工具。通过创建控制这两种分子结合和释放的新方法,现在可以开发出许多新的实验室技术来实现新的健康发现和改进的诊断测试。
他们的团队着手设计一个“开关”,使分子变得更加通用。根据需要,此开关将允许交互变得更紧密或更松散。
该研究小组最近将分子设计与链霉亲和素-生物素系统的先前知识相结合,发现了新引入的二硫键的作用,从而获得了成功,其中之一提高了键的强度,同时还产生了可逆的转换。他们使用萨斯喀彻温大学(加拿大萨斯卡通,加拿大)的加拿大光源(CLS)上的加拿大大分子晶体学设施(CMCF)光束线,分析了这些变化对链霉亲和素-生物素复合物结构的影响。NG表示,虽然该方法尚不完善,但切换足够温和,足以破坏部分分子键,而不会削弱该系统所需的紧密结合。
该发现涉及创建由氨基酸半胱氨酸的两个残基形成的特定桥。诀窍是将链桥(称为二硫键)放在链霉亲和素结构中的正确位置,以改变链霉亲和素与生物素之间的结合。
Ng说:“通过在结构的正确位置创建二硫键,这是这项工作中的新发现,您可以使结合更紧密。” “很酷的事情是,当您减少二硫键时,生物素与链霉亲和素的结合就会弱得多。像开关一样,松散的结合使链霉亲和素-生物素解体,这使其可逆,并解决了系统的最大问题。”
许多诊断测试和生物技术应用(例如配体捕获,蛋白质固定和蛋白质印迹)更喜欢紧密结合,从而留下永久的东西。当使用生物传感器检测的细菌或病毒,债券需要是紧,因此探针不会滑脱。
干细胞疗法等医学应用被用作治疗越来越多疾病的实验方法,通常需要可逆的疗法。需要牢固的键来抓住并保持在另一种蛋白质或细胞上,但是有一种释放它的方法也同样重要,尤其是当与用于医学治疗的精致活细胞一起工作时。
研究小组使用CLS比较了两个不同的二硫键的作用。该结构对于理解不同突变的引入如何影响生物素修饰的链霉亲和素的强度和稳定性至关重要。
团队惊讶地发现,一次变更导致交互作用弱得多,这与预期的相反。在CLS的帮助下,该小组能够将结果可视化,这有助于告知他们的设计并将其推向更完善的系统。